ΣΧΕΤΙΚΑ ΑΡΘΡΑ
Έλαβε άδεια χρήσης έκτακτης ανάγκης για δύο θεραπείες της κατά της λοίμωξης Covid-19 μέσα στις τελευταίες 15 ημέρες, ανοίγοντας νέους ορίζοντες στην διαχείριση της παγκόσμιας υγειονομικής κρίσης.
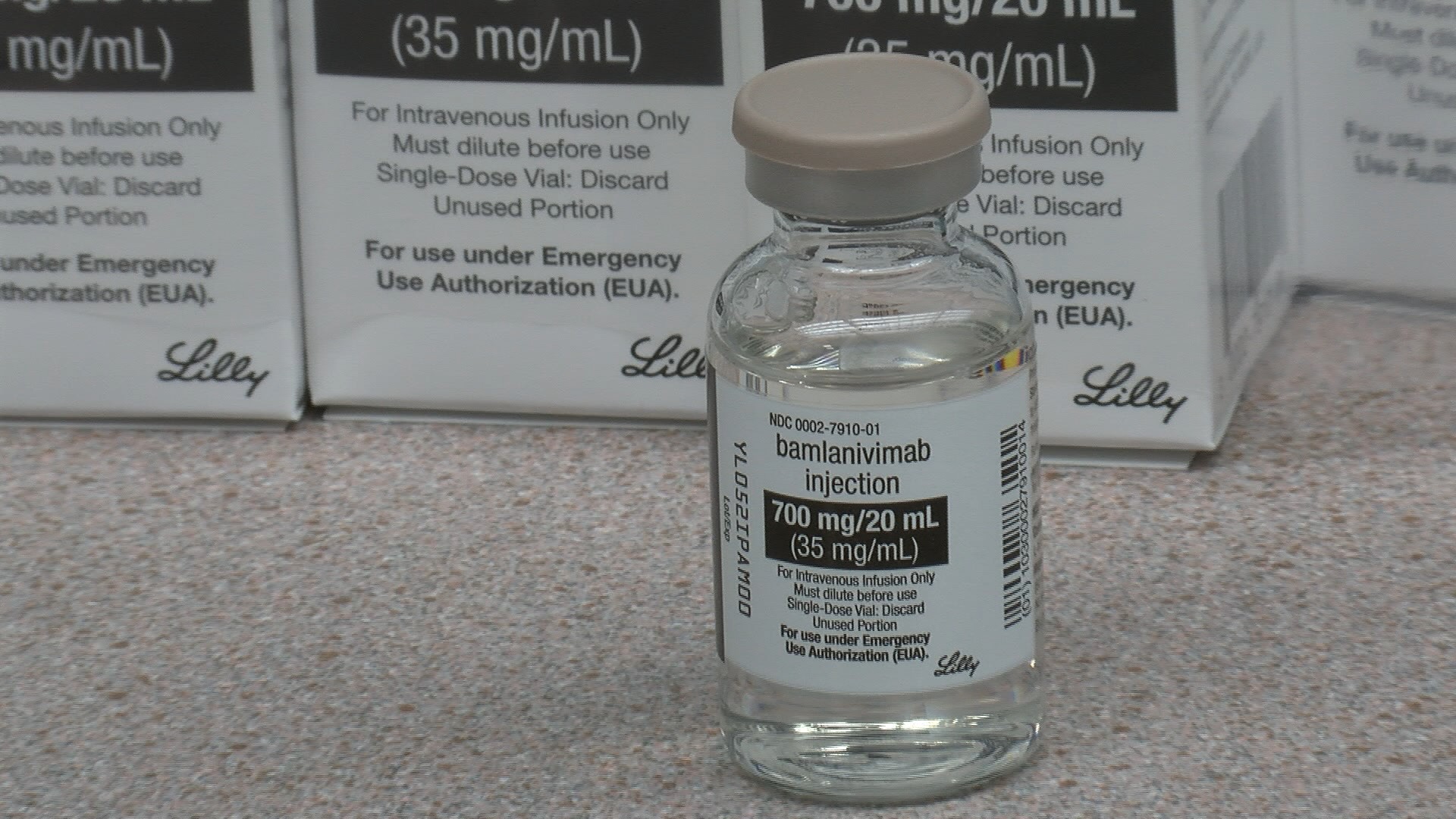
Στις 9/11 εγκρίθηκε στην Αμερική το πρώτο συνθετικό μονοκλωνικό αντίσωμα (bamlanivimab), για χορήγηση σε πρόσφατα διαγνωσθέντες ασθενείς υψηλού κινδύνου, με ήπια έως μέτρια νόσο.
Δέκα ημέρες αργότερα, ο Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) έδωσε το «πράσινο φως» για τη χρήση ενός ήδη χρησιμοποιούμενου φαρμάκου, της μπαρισιτινίμπης (σε συνδυασμό με τη ρεμντεσιβίρη), σε ασθενείς που χρειάζονται μηχανική υποστήριξη της αναπνοής.
Μέσα σε μερικές ημέρες, η Elli – Lilly κατατάχθηκε στις πλέον πρωτοπόρες εταιρείες που έχουν στρατευτεί στη μάχη κατά της πανδημίας, αυξάνοντας τον αριθμό των θεραπευτικών επιλογών, σε διαφορετικά στάδια της νόσου Covid-19.
Μιλώντας στο mononews.gr, ο Χρήστος Μαρτάκος, Corporate Affairs Director της Φαρμασέρβ-Λίλλυ, η οποία είναι αποκλειστικός αντιπρόσωπος της Elli-Lilly στην Ελλάδα, τονίζει -μεταξύ άλλων- ότι η εταιρεία «τρέχει» ένα ευρύ πρόγραμμα κλινικών δοκιμών για την αντιμετώπιση της Covid-19, αναφέρεται στις ήδη εγκεκριμένες θεραπείες, επισημαίνοντας τα βήματα που αναμένεται να γίνουν έτσι ώστε να μπορέσουν να χορηγηθούν και στη χώρα μας και αποκαλύπτει το μέγεθος του ρίσκου που έχει πάρει η εταιρεία, με την απόφασή της να παραγάγει το bamlanivimab, πριν ακόμα ολοκληρωθούν οι μελέτες φάσης ΙΙΙ.
Κύριε Μαρτάκο, το bamlanivimab είναι το πρώτο μονοκλωνικό αντίσωμα που έχει λάβει επείγουσα έγκριση για χορήγηση σε ασθενείς με Covid-19. Πότε ξεκίνησε να αναπτύσσεται και ποια είναι η δράση του;
Το Bamlanivimab είναι ένα συνθετικό μονοκλωνικό αντίσωμα (mAb), που προέρχεται από ένα από τα πρώτα δείγματα αίματος ασθενή που ανάρρωσε από COVID-19 στις Ηνωμένες Πολιτείες.
Το Bamlanivimab είναι ένα εξουδετερωτικό αντίσωμα, το οποίο στρέφεται εναντίον της SARS-CoV-2 spike (S) πρωτεΐνης και έτσι εμποδίζει την είσοδο του ιού στο κύτταρο.
Η έρευνα ξεκίνησε τον Φεβρουάριο του 2020 και το Bamlanivimab αναπτύχθηκε εν μέσω του πρώτου κύματος της πανδημίας. Σήμερα παρασκευάζεται στα εργοστάσια της Lilly, η οποία έχει δεσμευθεί για 1.000.000 δόσεις μέσα στο 2020.
Η έγκριση χορηγήθηκε με βάση τα αποτελέσματα κλινικής μελέτης φάσης ΙΙ. Πότε αναμένεται να ολοκληρωθεί η μελέτη φάσης ΙΙΙ και πόσο πιθανό είναι να ανατραπούν τα μέχρι στιγμής δεδομένα;
Είναι σε εξέλιξη κλινικές δοκιμές φάσης ΙΙΙ του αντισώματος που αφορούν σε ασθενείς σε πρώιμα στάδια της νόσου, οι οποίες αναμένεται να ολοκληρωθούν το Φεβρουάριο του 2021, αλλά και κλινικές δοκιμές για προφύλαξη από τη νόσο Covid-19, οι οποίες αναμένεται να ολοκληρωθούν τον Ιούνιο του 2021. Τα μέχρι σήμερα στοιχεία φαίνεται να επιβεβαιώνουν την αποτελεσματικότητα και ασφάλεια του προϊόντος.
Πότε εκτιμάται ότι θα πάρει έγκριση στην Ευρώπη, πότε θα το έχουμε στην Ελλάδα και πώς θα εισαχθεί στη χώρα μας;
Αναφορικά με τη χώρα μας, είμαστε ήδη σε επαφή με τους αρμόδιους φορείς, ώστε να καταστεί δυνατή η εισαγωγή στην Ελλάδα και η διάθεση του στα νοσηλευτικά Ιδρύματα.
Η χορήγηση του απαιτείται να γίνεται σε νοσηλευτικό Ίδρυμα (νοσοκομείο ή και κέντρο Υγείας) και αυτό γιατί χορηγείται με ενδοφλέβια έγχυση.
Για τα ευρωπαϊκά δεδομένα δεν έχουμε εικόνα. Αυτό που γνωρίζουμε είναι ότι η Αδειοδότηση ανά χώρα, από τους τοπικούς οργανισμούς φαρμάκου, μπορεί να προχωρήσει ταχύτερα.
Έχει χρησιμοποιηθεί σε επίπεδο δοκιμής στην Ελλάδα και αν ναι τι έχει δείξει η εμπειρία από τη χώρα μας;
Η ανάπτυξη μια κλινικής δοκιμής φάσης ΙΙ αλλά και ΙΙΙ είναι μια δύσκολη και πολύπλοκη διαδικασία, η οποία εν μέσω πανδημίας έγινε ακόμη δυσκολότερη. Αυτό είχε σαν αποτέλεσμα οι κλινικές δοκιμές να γίνουν σε γεωγραφικά περιορισμένο χώρο. Στην Ελλάδα δεν είχαμε την τύχη να έχουμε κλινική έρευνα για αυτό το προϊόν.
Ποια είναι η τιμή του στην Αμερική και ποια θα είναι η διαδικασία διαπραγμάτευσης στην Ευρώπη;
Για τις κεντρικές διαδικασίες με την Ευρώπη δεν γνωρίζουμε. Αυτό που γνωρίζουμε είναι ότι ο Ευρωπαϊκός Οργανισμός Φαρμάκων δεν έχει μέχρι σήμερα διαδικασία χορήγησης άδειας κατεπείγουσας χρήσης-χορήγησης.
Η Εταιρεία μας απευθύνεται στους τοπικούς οργανισμούς Φαρμάκων, ώστε να επιταχύνει όσο είναι δυνατόν την διαθεσιμότητα του Bamlanivimab σε κάθε χώρα χωριστά.
Όπως ήδη έχει ανακοινωθεί, η Lilly έχει συμφωνήσει για 300.000 δόσεις με την κυβέρνηση των ΗΠΑ για το 2020, από τις οποίες έχουν ήδη χορηγηθεί πάνω από 80.000.
Το κόστος για κάθε δόση είναι της τάξης των 1000€, πραγματικά συμβολική αν κανείς υπολογίσει το κόστος νοσηλείας και την επιβάρυνση των συστημάτων υγείας.
Να τονίσω ότι η χορήγηση γίνεται μια φορά και, αν χορηγηθεί εγκαίρως, μειώνει τις νοσηλείες σε ποσοστό 70%.
Τι συμφωνίες έχουν γίνει μέχρι στιγμής και πώς αναμένεται να επηρεάσει ο όγκος των παραγγελιών το κόστος;
Εκτός από τη συμφωνία με τις ΗΠΑ, η Lilly, έχει δεσμευθεί για την διάθεση 700.000 δόσεων εντός του 2020, για χρήση εκτός των ΗΠΑ. Το κόστος δεν θα επηρεαστεί από τον όγκο παραγγελιών.
Το σημαντικό είναι να έχουμε την δυνατότητα να το έχουμε διαθέσιμο και στη χώρα μας. Όπως σας είπα, είμαστε σε επαφή με τις αρχές για να μπορέσουμε να το έχουμε διαθέσιμο στη χώρα.
Στη Φαρμασέρβ-Λίλλυ είμαστε αποφασισμένοι, σε συνεργασία με τις αρχές, να κάνουμε ό,τι χρειάζεται για να γίνει αυτό δυνατό.
Η Eli Lilly γνωστοποίησε ότι θα παραγάγει ένα εκατομμύριο δόσεις έως το τέλος του 2020. Στην απευκταία περίπτωση που η μελέτη φάσης ΙΙΙ δεν έχει θετική έκβαση, ποιο είναι το κόστος που θα επωμιστεί η εταιρεία;
Καταρχήν, ευχόμαστε να πάνε όλα καλά και το Bamlanivimab να αποδειχθεί δραστικό και αποτελεσματικό στη νόσο Covid-19, σώζοντας ασθενείς που νοσούν από αυτή.
Το κόστος που επωμίζεται η Εταιρεία δεν είναι δυνατό να υπολογιστεί, αλλά θα είναι της τάξης αρκετών εκατοντάδων εκατομμύριων δολαρίων. Θέλω να λάβετε υπόψη σας ότι το παραγωγικό πλάνο της εταιρείας άλλαξε έτσι ώστε να μπορέσει να ανταποκριθεί στη επείγουσα ανάγκη για την αντιμετώπιση της νόσου Covid-19.
Κατά την περίοδο της πανδημίας υπάρχει μια τεράστια πρόοδος στον τομέα Ε&Α. Πιστεύετε ότι η εξέλιξη αυτή θα αλλάξει τα δεδομένα της φαρμακοβιομηχανίας μακροπρόθεσμα ή πρόκειται για ένα παροδικό φαινόμενο που επιβάλλουν οι συνθήκες;
Είναι γνωστό ότι επείγουσες και πιεστικές καταστάσεις επιταχύνουν την Έρευνα και Ανάπτυξη νέων τεχνολογιών και τα φάρμακα είναι νέες τεχνολογίες. Ωστόσο, η Φαρμακοβιομηχανία επενδύει 15 με 20% του ετήσιου τζίρου της για να δώσει απαντήσεις σε ανικανοποίητες ανάγκες στην υγεία, εκείνο που συνέβη στην πανδημία είναι η επιτάχυνση στις εγκριτικές διαδικασίες και η χρήση της ψηφιακής τεχνολογίας ώστε να ικανοποιηθούν οι απαιτήσεις για τη διεξαγωγή των κλινικών δοκιμών.
Θεωρώ ότι μετά την πανδημία θα υπάρξει μια επανεκτίμηση, στις εγκριτικές διαδικασίες αλλά και στην ευρύτερη χρήση ψηφιακών μέσων, χωρίς βέβαια εκπτώσεις στην ποιότητα και τους ελέγχους.
Στις 19/11 η Lilly έλαβε τη δεύτερη έγκριση για θεραπεία της κατά της Covid-19 (μπαρισιτινίμπη σε συνδυασμό με τη ρεμντεσιβίρη), αυξάνοντας τον αριθμό των θεραπευτικών επιλογών σε διαφορετικά στάδια της νόσου. Πότε αναμένεται η σχετική έγκριση από τον Ευρωπαϊκό Οργανισμό Φαρμάκων και ποιο θα είναι το όφελος που θα προσφέρει. Διερευνώνται και άλλες θεραπείες της εταιρείας στη λοίμωξη από το νέο κορονοϊό;
Η Lilly έχει ένα ευρύ πρόγραμμα κλινικών δοκιμών για την αντιμετώπιση της νόσου Covid-19 και όλοι ελπίζουμε τα καλά νέα των τελευταίων εβδομάδων να συνεχιστούν.
Παρατηρούμε μια διαφορετική προσέγγιση του Ευρωπαϊκού Οργανισμού Φαρμάκου σε σύγκριση με τον αμερικανικό FDA. Μια θεμελιώδης διαφορά είναι ότι ο στόχος του FDA, όπως δήλωσε και ο Επίτροπος του Stephen M. Hahn MD, είναι να καταστήσει διαθέσιμες τις πιθανές θεραπείες COVID-19 εγκαίρως και όπου αυτές ενδείκνυνται, ενώ συνεχίζεται η έρευνα για περαιτέρω αξιολόγηση της ασφάλειας και αποτελεσματικότητας τους. Στην προσπάθεια αυτή ο FDA χρησιμοποιεί κάθε δυνατή οδό για να διευκολύνει τις νέες θεραπείες ώστε αυτές να είναι διαθέσιμες στην αντιμετώπιση της νόσου COVID-19, όσο το δυνατόν γρηγορότερα.
Αυτό δεν συμβαίνει μέχρι τώρα με τον Ευρωπαϊκό Οργανισμό Φαρμάκων. Στη χώρα μας μετά την πράξη νομοθετικού περιεχομένου του Μαρτίου 2020, οι θεραπείες αυτές διευκολύνονται να εφαρμοστούν από τους επιστήμονες με την σύμφωνη πάντα γνώμη του ασθενούς, του θεράποντος ιατρού και της πολιτείας.
Αυτό μας κάνει αισιόδοξους ότι σύντομα οι καινοτόμες αυτές θεραπείες θα είναι διαθέσιμες και στη χώρα μας.
Από την έναρξη της πανδημίας COVID-19, η Lilly έχει δεσμευτεί να βρει πιθανές θεραπείες για να βοηθήσει ανθρώπους σε όλο τον κόσμο που έχουν προσβληθεί από αυτόν τον ιό, αυξάνοντας τον αριθμό των θεραπευτικών επιλογών στα διάφορα στάδια της νόσου. Κάνουμε δε σαν εταιρεία ότι είναι δυνατό για να είναι διαθέσιμες αυτές οι καινοτόμες θεραπείες και στη χώρα μας, οι οποίες στα χέρια των ειδικών αποτελούν όπλα για την αντιμετώπιση της νόσου.













Μοιραστείτε την άποψή σας
ΣχόλιαΓια να σχολιάσετε χρησιμοποιήστε ένα ψευδώνυμο. Παρακαλούμε σχολιάζετε με σεβασμό. Χρησιμοποιείτε κατανοητή γλώσσα και αποφύγετε διατυπώσεις που θα μπορούσαν να παρερμηνευτούν ή να θεωρηθούν προσβλητικές. Με την ανάρτηση σχολίου, συμφωνείτε να τηρείτε τους Όρους του ιστότοπου contact Δημιουργήστε το account σας εδώ, για να κάνετε like, dislike ή report ακατάλληλα/προσβλητικά σχόλια.