ΣΧΕΤΙΚΑ ΑΡΘΡΑ
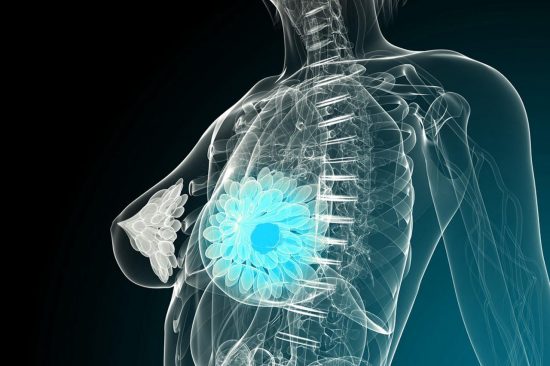
Ο FDA ενέκρινε την ριμποσικλίμπη, της Novartis, ως θεραπεία πρώτης γραμμής για HR+/HER2- μεταστατικό καρκίνο του μαστού, σε συνδυασμό με οποιονδήποτε αναστολέα αρωματάσης.
Ειδικότερα, o Οργανισμός Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) ενέκρινε τη ριμποσικλίμπη (προηγουμένως γνωστή ως LEE011) σε συνδυασμό με αναστολέα αρωματάσης ως αρχική ενδοκρινική θεραπεία για την αντιμετώπιση μετεμμηνοπαυσιακών γυναικών με ορμονοευαίσθητο, αρνητικό στους υποδοχείς του ανθρώπινου επιδερμικού αυξητικού παράγοντα-2 (HR+/HER2-) προχωρημένο ή μεταστατικό καρκίνο του μαστού.
Η ριμποσικλίμπη είναι αναστολέας της CDK4/6, που έχει εγκριθεί με βάση την κλινική δοκιμή Φάσης ΙΙΙ πρώτης γραμμής η οποία πέτυχε νωρίς το κύριο καταληκτικό της σημείο, καταδεικνύοντας στατιστικώς σημαντική βελτίωση στην επιβίωση ελεύθερη εξέλιξης νόσου (PFS) σε σύγκριση με μόνη τη λετροζόλη, στην πρώτη, προσχεδιασμένη ενδιάμεση ανάλυση. Η ριμποσικλίμπη ελέγχθηκε και εγκρίθηκε στο πλαίσιο των προγραμμάτων Ελέγχου κατά Προτεραιότητα και ορισμού ως Καινοτόμου Θεραπείας του FDA.
«Η ριμποσικλίμπη συμβολίζει την καινοτομία που εξακολουθεί να προωθεί η Novartis για ασθενείς με HR+/HER2- μεταστατικό καρκίνο του μαστού», είπε ο Bruno Strigini, CEO, Novartis Oncology. «Είμαστε υπερήφανοι για το ολοκληρωμένο κλινικό πρόγραμμα της ριμποσικλίμπης το οποίο οδήγησε στη σημερινή έγκριση και για τη νέα ελπίδα που αυτό το φάρμακο αντιπροσωπεύει για τις ασθενείς και τις οικογένειές τους».
Η έγκριση από τον FDA βασίζεται στη μεγαλύτερη αποτελεσματικότητα και στην αποδεδειγμένη ασφάλεια της ριμποσικλίμπης σε συνδυασμό με λετροζόλη έναντι της θεραπείας μόνο με λετροζόλη στην κλινική δοκιμή Φάσης ΙΙΙ MONALEESA-2. Η μελέτη, στην οποία συμμετείχαν 668 μετεμμηνοπαυσιακές γυναίκες με HR+/HER2- προχωρημένο ή μεταστατικό καρκίνο του μαστού, οι οποίες δεν είχαν λάβει προηγούμενη συστηματική θεραπεία για τον προχωρημένο καρκίνο του μαστού, έδειξε ότι η ριμποσικλίμπη μαζί με αναστολέα αρωματάσης (λετροζόλη), μείωσε τον κίνδυνο εξέλιξης της νόσου ή θανάτου κατά 44% σε σύγκριση με μόνη τη λετροζόλη.
Περισσότερες από τις μισές ασθενείς που ελάμβαναν τη ριμποσικλίμπη σε συνδυασμό με λετροζόλη παρέμειναν εν ζωή και ελεύθερες εξέλιξης νόσου κατά τον χρόνο της ενδιάμεσης ανάλυσης και, κατά συνέπεια, η διάμεση επιβίωση ελεύθερη εξέλιξης νόσου (PFS) δεν ήταν δυνατόν να καθοριστεί. Σε μεταγενέστερη ανάλυση με πρόσθετο διάστημα παρακολούθησης 11 μηνών και συμβάματα εξέλιξης, παρατηρήθηκε διάμεση επιβίωση ελεύθερη εξέλιξης νόσου (PFS) 25,3 μηνών για τη ριμποσικλίμπη σε συνδυασμό με λετροζόλη και 16,0 μηνών για μόνη τη λετροζόλη. Τα δεδομένα συνολικής επιβίωσης δεν είναι ακόμη ώριμα και θα είναι διαθέσιμα σε μεταγενέστερο χρόνο.
«Στη μελέτη MONALEESA-2 , η ριμποσικλίμπη σε συνδυασμό με λετροζόλη μείωσε τον κίνδυνο εξέλιξης της νόσου ή θανάτου κατά 44% σε σύγκριση με μόνη τη λετροζόλη και περισσότερες από τις μισές ασθενείς (53%) με μετρήσιμη νόσο που ελάμβαναν ριμποσικλίμπη σε συνδυασμό με λετροζόλη παρουσίασαν μείωση του φορτίου του όγκου κατά τουλάχιστον 30%. Αυτό είναι ένα σημαντικό αποτέλεσμα για τις γυναίκες με αυτή τη σοβαρή μορφή καρκίνου του μαστού», ανέφερε ο Gabriel N. Hortobagyi, MD, Καθηγητής Ιατρικής στο Τμήμα Ιατρικής Ογκολογίας Μαστού του Κέντρου Καρκίνου MD Anderson του Πανεπιστημίου του Τέξας και Κύριος Ερευνητής της MONALEESA-2. «Τα αποτελέσματα αυτά επιβεβαιώνουν ότι η συνδυαστική θεραπεία με αναστολέα CDK4/6 όπως η ριμποσικλίμπη και έναν αναστολέα αρωματάσης θα πρέπει να είναι το νέο πρότυπο φροντίδας για την αρχική θεραπεία για ορμονοθετικό προχωρημένο καρκίνο του μαστού».
Η ριμποσικλίμπη λαμβάνεται με ή χωρίς φαγητό, χορηγούμενο από το στόμα μία φορά την ημέρα, σε δόση 600 mg (τρία δισκία των 200 mg) επί τρεις εβδομάδες, ακολουθούμενες από διάστημα μίας εβδομάδας εκτός θεραπείας. Η ριμποσικλίμπη λαμβάνεται σε συνδυασμό με τέσσερις εβδομάδες θεραπείας με οποιονδήποτε αναστολέα της αρωματάσης.
ΔΙΑΒΑΣΤΕ ΑΚΟΜΗ: Όλη η αλήθεια για τη δυσλιπιδαιμία
ΔΕΙΤΕ ΕΠΙΣΗΣ: Pembrolizumab: Επιταχυνόμενη έγκριση από τον FDA για το Λέμφωμα Hodgkin
ΜΗ ΧΑΣΕΤΕ: Ψωρίαση: Καθαρό δέρμα μετά από επανέναρξη της θεραπείας με σεκουκινουμάμπη
ΕΙΔΗΣΕΙΣ ΣΗΜΕΡΑ
- Βαλεντίνα Μπαρτολίνι: «Η φλόγα σε καλεί να σκεφτείς»
- Γιατί έφτασε κοντά στο… κραχ η μπασκετική Μονακό! Φεύγει ο ζάπλουτος Φεντορίτσεφ, παρεμβαίνει το Πριγκιπάτο
- Νευρικότητα στις αγορές πετρελαίου, καθώς ο Τραμπ «χτίζει» πολεμικό κλίμα εναντίον του Ιράν
- Από τον Νίξον στον Κάρτερ – και στον Τραμπ: Έρχεται η τρίτη κρίση του δολαρίου












Μοιραστείτε την άποψή σας
ΣχόλιαΓια να σχολιάσετε χρησιμοποιήστε ένα ψευδώνυμο. Παρακαλούμε σχολιάζετε με σεβασμό. Χρησιμοποιείτε κατανοητή γλώσσα και αποφύγετε διατυπώσεις που θα μπορούσαν να παρερμηνευτούν ή να θεωρηθούν προσβλητικές. Με την ανάρτηση σχολίου, συμφωνείτε να τηρείτε τους Όρους του ιστότοπου contact Δημιουργήστε το account σας εδώ, για να κάνετε like, dislike ή report ακατάλληλα/προσβλητικά σχόλια.